酸性の水溶液の性質と特徴をわかりやすくまとめます。
このページでは
- 酸性の水溶液の性質と特徴
- 「酸」と「酸性」の違い
- 酸性の水溶液と色の変化
- 中学生が覚えるべき酸性の水溶液
についてそれぞれ解説します。
このページを読めば4分でバッチリだよ!
中学理科の成績を伸ばせる塾!「さわにい理科塾」を始めました!詳しく知りたい方はこちら。さわにい本人のサポートで成績UPです!
それでは酸性の水溶液の学習スタート!
酸性の水溶液の性質と特徴
酸性の水溶液の性質と特徴は次の通り。
- 青色のリトマス紙を赤色に変える
- BTB溶液を黄色に変える
- 鉄・マグネシウム・亜鉛などの金属を加えると水素が発生する
- なめると酸っぱい
中学3年生で学習した人は
- pHが7よりも小さい
- 電解質の水溶液である(電気を通す液体ということ)
も追加でしっかりと覚えておこう!
レモン汁や酢も酸性なんだね!
酸と酸性の違い
中学3年生で学習した人は確認しておこう!
1.2年生は飛ばしていいよ!
「酸」と「酸性」の違いはわかるかな?
 ねこ吉
ねこ吉同じじゃないの?
似てるけど、同じではないんだよ!
簡単に説明しておくね!
酸とは
酸とは
- 水に溶けると水溶液が酸性になる物質のこと。
- 水に溶けると水素イオン(H+)を生じる物質のこと。
だよ。
つまり、
「水に溶かす前」
の状態なんだね!
酸性とは
酸性とは
①水の中に水素イオン(H+)を含む溶液。
のことだよ。
特徴は
- 青色のリトマス紙を赤色に変える
- BTB溶液を黄色に変える
- 鉄・マグネシウム・亜鉛(あえん)などの金属を加えると水素が発生する
- なめると酸っぱい
だったね!
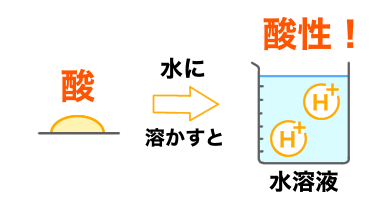
だけどここで大切なことなことは
酸性は「水に溶けた後」
の状態ということなんだ!
「溶液(液体)」の状態ということだよ!
図にすると下のようになるね!

まとめ
もう一度繰り返すね!
酸とは
- 水に溶けると水溶液が酸性になる物質。
- 水に溶けると水素イオン(H+)を生じる物質。
つまり、
「水に溶かす前」
酸性とは
①水の中に水素イオン(H+)を含む溶液。
つまり、
「水に溶けた後」
なんだ!


しっかりと確認しておこう!
これで酸と酸性の違いの解説を終わるよ!
酸性の水溶液と色の変化
水溶液が
- 酸性
- 中性
- アルカリ性
のどれかを調べるために
色々な指示薬が使われるよ!
酸性を確かめるために使われる指示薬は主に
- リトマス紙
- BTB溶液
の2つだね!
この2つは何性かによって色が変化するんだったよね!
色の変化を下の表にまとめておくね!
| 酸性 | 中性 | アルカリ性 | |
| 赤色リトマス紙 | 変化なし | 変化なし | 赤→青 |
| 青色リトマス紙 | 青→赤 | 変化なし | 変化なし |
| BTB溶液 | 黄色 | 緑色 | 青色 |
色の変化を動画で見たい人は見てみてね!
これらの色の変化は必ず覚えておこう!
中学生が覚えるべき酸性の水溶液
中学生が覚えなければいけない酸性の水溶液をまとめておくね!
下の表を見てみよう!
赤字は大切なものだよ!
| 強い酸性 | 弱い酸性 |
| 塩酸 | 炭酸 |
| 硫酸(りゅうさん) | 酢酸 |
| 硝酸(しょうさん) | クエン酸 |
「塩酸」は水に塩化水素を溶かしたもの
「炭酸」は水に二酸化炭素を溶かしたもの
「酢酸」は酢の主成分
「クエン酸」はミカンなどに含まれる成分
だね!
これで「酸性の水溶液の性質と特徴のまとめ」
の解説を終わるね!
またいつでも遊びに来てね!



ばいばいー
また、このページと同じような内容だけど
こちらもしっかりと確認しておいてね!
さわにいは、登録者8万人の教育YouTuberです。
中学の成績を上げたい人は、ぜひYouTubeも見てみてね!
また、2022年10月に学習参考書も出版しました。よろしくお願いします。
他のページも見たい人はトップページへどうぞ。


今なら相談無料です



またねー












コメント