水の電気分解の分解の中学生向け解説ページです。
「水の電気分解」
は中学2年生の化学で学習します。
- 水の電気分解の実験動画
- 水の電気分解で何ができるのか
- 水の電気分解の化学反応式
- 水は熱分解ができるか(おまけ)
を学習したい人は
このページを読めばバッチリだよ!
急いでいる人のために、ポイントをまとめておくね!
急いでいる人のためのまとめ
①水の電気分解でできるもの
陽極(+側)→酸素 陰極(-側)→水素
(オススメの語呂合わせも紹介するよ)
②水の電気分解の化学反応式
2H2O → 2H2 + O2
③水の電気分解を行うときに水酸化ナトリウムを入れる理由
電気を通しやすくするために入れる。
(純粋な水はほとんど電気を通さない)
だね。
詳しい解説や実験動画は下へと読み進めてね☆
中学理科の成績を伸ばせる塾!「さわにい理科塾」を始めました!詳しく知りたい方はこちら。さわにい本人のサポートで成績UPです!
それでは水の電気分解の学習スタート!
(目次から好きなところに飛べるよ)
水の電気分解の実験
水の電気分解の実験動画
水の電気分解は中学2年生で学習する内容だね。
水に電気を流すと、「水素」と「酸素」に分解することができるんだ。
まずは動画で見てみよう!
 ねこ吉
ねこ吉おお。気体が発生して、火がつく様子が見れるね!
うん。とても面白い実験だね!
では、実験を詳しく確認していこう。
②水の電気分解で発生するもの
陽極(+側)からは酸素が発生するよ。
酸素の確かめ方は、「火のついた線香を近づける」だね。
酸素が発生していると、線香が激しく燃えるんだよ!
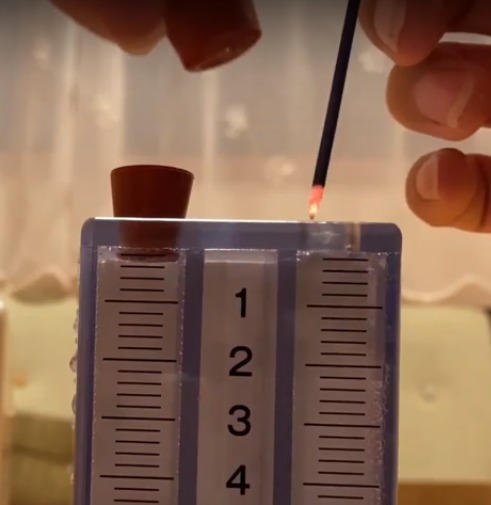

陰極(-側)からは水素が発生するよ。
水素の確かめ方は、「火のついたマッチを近づける」だね。



酸素の時は線香なのに、水素の時はマッチなの?
そうなんだ。
- 酸素の確かめ方 → 線香
- 水素の確かめ方 → マッチ
これを覚えておくと便利だから、ついでに覚えておこうね!
水素が発生していると、マッチが音を激しく燃えるんだよ!


水の電気分解で発生する気体の覚え方
ここまでは大丈夫かな?
- 陽極(+側)→酸素
- 陰極(-側)→水素
だね。



どっちが酸素でどっちが水素か。
覚えにくい…。
確かに覚えにくいね。
そんなときはゴロ合わせで覚えてみよう!
「プーさんスイマー」
という語呂合わせがオススメだよ。
プー(プラス)さん(酸素)
スイ(水素)マー(マイナス)
という感じで、プーさんがスイマー(泳ぐ人)になって泳いでいるイメージだね!


水素と酸素の体積比
実験で大切なポイントがもう一つあるよ。
それは、
水素は酸素の2倍の量が発生する。
ということなんだ。





なんで水素は2倍の量が発生するの?
ちゃんと理由があるんだよ。
この後の「化学反応式」のところで詳しく解説するね!
水の電気分解で水酸化ナトリウムを入れる理由
最後にもう一つポイントだよ。
実は、純粋な水(水の中に全く何も入っていない水)は電気をほとんど通さないんだ。



電気が流れなければ、電気分解ができないね。
うん。だから水を通しやすくするために、
「水酸化ナトリウム」
を少量入れて、電気を通しやすくして実験を行うんだ。
テストに出やすいから、しっかりと覚えておこう。
また、水酸化ナトリウムは非常に危険だから、先生の言うことをしっかりと聞いて実験を行ってね!


水の電気分解の化学反応式
では、水の電気分解の化学反応式を確認しよう。
水の電気分解で使う化学式
まずは化学式の確認だよ。
水の化学式は
H2O だね。
モデル(絵)で書くと
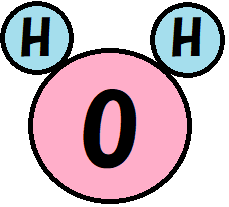
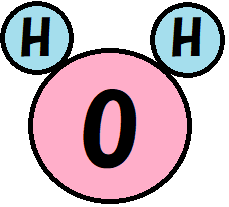
だね。
水素(分子)の化学式は
H2 だね。
モデル(絵)で書くと


だね。
次に、
酸素(分子)の化学式は
O2 だね。
モデル(絵)で書くと


だね。
まずはこの化学式をしっかりと覚えてね!
化学式を正確に覚えないと、化学反応式は書けないんだよね!
そうそう。しっかりと覚えてね。
水の電気分解の化学反応式
では、水の電気分解の化学反応式を確認しよう。
水の電気分解の化学反応式は下のとおりだよ!
2H2O → 2H2 + O2
だよ!



先生、式の書き方はどうだっけ?
では、1から解説するね。
まず、日本語で化学反応式を書いてみよう!
「水」が「水素」と「酸素」に分かれるんだね。
① 水 → 水素 + 酸素
(慣れたら省略していいよ。)
次に、①の日本語を化学式にそれぞれ変えるよ。
② H2O → H2 + O2
だね。
これで完成にしたいけれど、
H2O → H2 + O2
![]()
![]()
![]()
![]()
![]()
![]()
のままでは、矢印の左と右で原子の数が合っていないね。



矢印の左側に酸素原子が1つ足りないね。
うん。
この場合は両側で原子の数を合わせないといけないんだよ。
それでは係数をつけて、
原子の個数を矢印の左右でそろえていくよ。
係数は化学式の前、


のピンクの四角の中にしか書いてはいけないね。
右下の小さい数字を書いたり変えたりしないでね。
それでは係数を書いて、左右の原子の個数をそろえよう。


![]()
![]()
![]()
![]()
![]()
![]()
今、矢印の左側の酸素原子が1個たりないね。
足りない所を増やしていけば、いつか必ず数がそろうよ。
では、左側の水の前に係数をつけて、増やしてみよう。


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
これで左右の酸素原子の数がそろったね!



だけど、水素原子の数が合わなくなってしまったよ!
うん。では、今度は矢印の右側に水素を増やそう。
足りない所を増やしていけば、いつか必ず数がそろうからね。


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
これで、矢印の左右で原子の数がそろったね。
つまり、化学反応式の完成なんだね。
水の電気分解の化学反応式は
2H2O → 2H2 + O2
だね!
ところで、
「水の電気分解では、水素が酸素の2倍の量できる」
という話は覚えているかな?



そうそう。その理由を教えて下さい!
今作った化学反応式を見てみよう。
2H2O → 2H2 + O2
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
ほら。水素が酸素の2倍の量できているよね!



あ、ほんとだ!
水素分子が2つ。
酸素分子が1つ。
だもんね。
このような理由で、水素は酸素の2倍の量の体積が発生したんだね。



化学反応式を見れば、当たり前の結果なんだね。
これで水の電気分解の学習を終わるね!
まとめ
①水の電気分解でできるもの
陽極(+側)→酸素 陰極(-側)→水素
(オススメの語呂合わせも紹介するよ)
②水の電気分解の化学反応式
2H2O → 2H2 + O2
③水の電気分解を行うときに水酸化ナトリウムを入れる理由
電気を通しやすくするために入れる。
(純粋な水はほとんど電気を通さない)
だね。
他の中学2年実験解説は下のリンクを使ってね!
実験動画つきでしっかり学習できるよ!



またねー
さわにいは、登録者8万人の教育YouTuberです。
中学の成績を上げたい人は、ぜひYouTubeも見てみてね!
また、2022年10月に学習参考書も出版しました。よろしくお願いします。
他のページも見たい人はトップページへどうぞ。


今なら相談無料です












コメント
コメント一覧 (2件)
さわにいさんの解説のおかげで小テスト2枚とも100点取れました!
要点がまとめられていてとても分かりやすかったです!本当にありがとうございます!
かにたまさんの努力の成果ですね!
お役に立ててよかったです!
これからも応援しています!