中学2年で学習する実験のまとめです。
素早く確認したい時に使ってください☆
中学2年の化学実験まとめ(分解)
1種類の物質が2種類以上の物質に分かれる化学変化(化学反応)を分解という。
① 酸化銀の熱分解
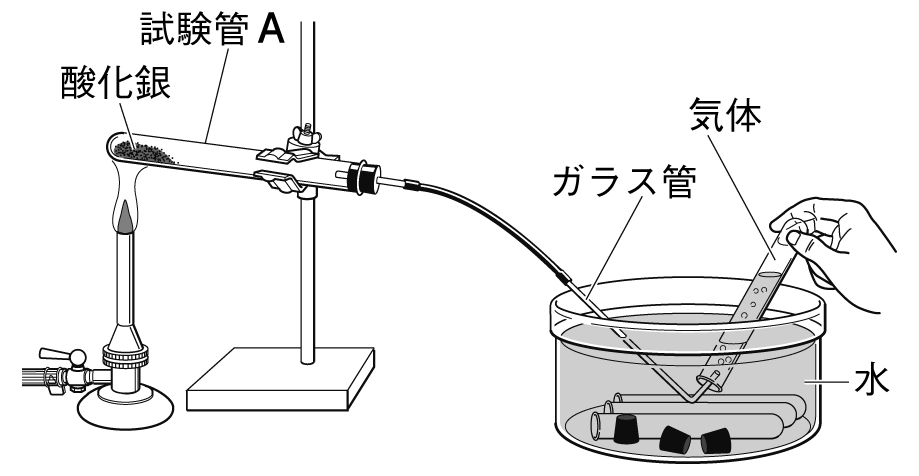
酸化銀を加熱すると銀と酸素に分かれる。
酸化銀の化学式はAg2Oである。
この実験で発生した気体に、火のついた線香を近づけると激しく燃える。
この実験で発生した気体は、水上置換法で集める。
酸化銀の色は黒色である。
加熱してできた白い物質をこすると金属光沢がでる。
加熱してできた白い物質をたたくと、うすく広がる。
加熱してできた白い物質は電流が流れる。
この実験の化学反応式は 2Ag2O → 4Ag + O2
② 炭酸水素ナトリウムの熱分解
炭酸水素ナトリウムを加熱すると、炭酸ナトリウム・水・二酸化炭素に分解される。
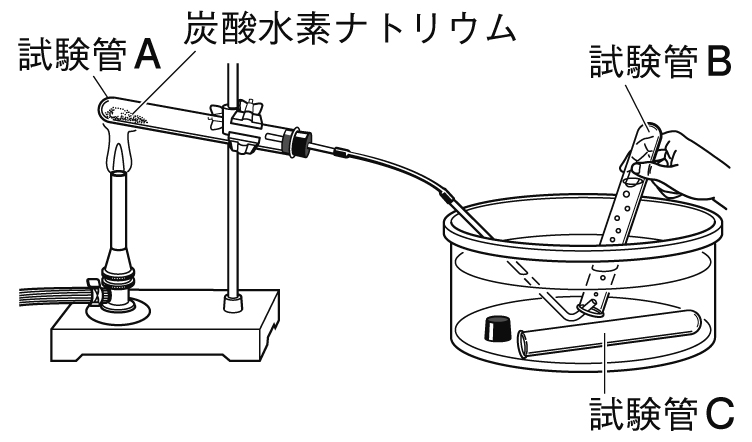
この実験では、試験管を加熱する際、試験管の口が下側を向くようにする。
その理由は、発生した液体(水)が加熱部分に流れ込むと、試験管が割れる恐れがあるためである。
炭酸水素ナトリウムの化学式はNaHCO3である。
炭酸ナトリウムの化学式はNa2CO3である。
この実験で発生した気体を石灰水に入れると、石灰水は白くにごる。
この実験で発生した気体は、水上置換法か、下方置換法で集める。
この実験で発生した液体に、塩化コバルト紙をつけると、色が青色から赤色に変わる。
加熱前の白い粉の名前は炭酸水素ナトリウム。
加熱後の白い粉の名前は炭酸ナトリウム。
炭酸水素ナトリウムは水に溶かすと弱いアルカリ性である。
炭酸ナトリウムは水に溶かすと強いアルカリ性である。
炭酸水素ナトリウムを水に溶かし、フェノールフタレイン液を加えるとうすい赤色になる。
炭酸ナトリウムを水に溶かし、フェノールフタレイン液を加えると、濃い赤色になる。
(フェノールフタレイン液→アルカリ性だと赤色になる溶液)
炭酸水素ナトリウムは水に少し溶ける。
炭酸ナトリウムは水によく溶ける。
この実験の化学反応式は 2NaHCO3 → Na2CO3 + H2O + CO2
★ NaHCO3は「ナホコサン」、Na2CO2は「ナツコサン」と覚えるとよい。
③ 水の電気分解
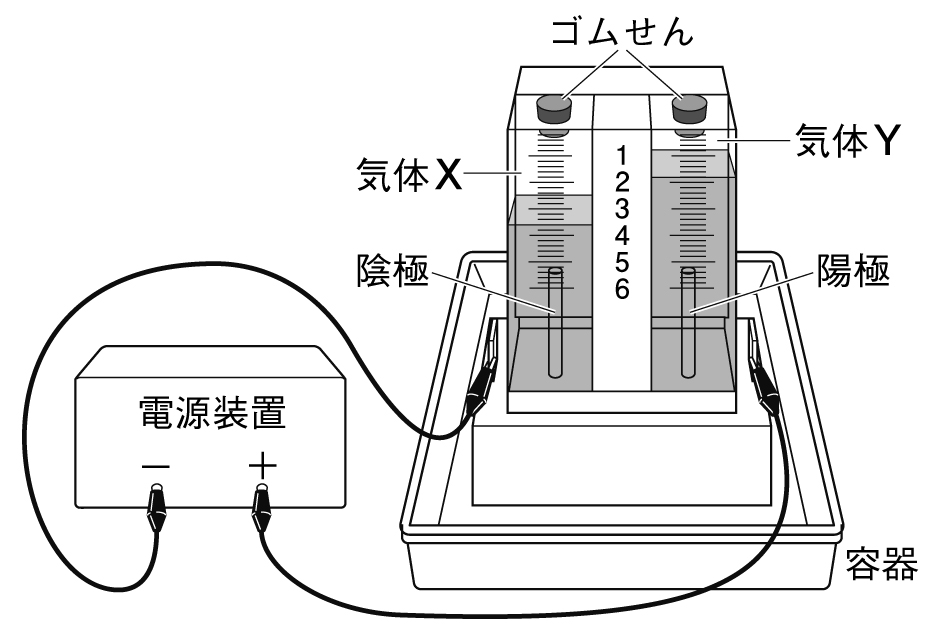
水は熱分解をすることはできないが、電気分解をすることができる。
水を電気分解すると、水素と酸素に分かれる。
この実験を行うときは、水に水酸化ナトリウムを加える。
その理由は、小さな電圧で分解を進めるため(電気を通しやすくするため。)である。
この実験を行うと、陽極(+につないでいる側)と陰極(-につないでいる側)から気体が発生する。
陽極からは酸素が発生する。
陰極からは水素が発生する。
★ +からは酸素、-からは水素なので、プーさんスイマーと覚える。(プーさんが泳ぐ)
陽極から発生した気体(酸素)に火のついた線香を近づけると、線香が激しく燃える。
陰極から発生した気体(水素)に火のついたマッチを近づけると、気体が音をたてて燃える(燃えて水ができる)。
発生した気体の割合は、水素:酸素=2:1 である。
この実験の化学反応式は 2H2O → 2H2 + O2
中学2年の化学実験まとめ(化合)
注意
2023年以降は「化合」という言葉は用いず、「物質が結びつく化学変化」と表現されます。
2種類以上の物質が1種類の物質に結び付く化学変化(化学反応)を化合という。
① 鉄と硫黄の化合
加熱前の物質は鉄と硫黄の混合物である。
加熱後は化学変化がおこり、鉄と硫黄の化合物(硫化鉄)となる。
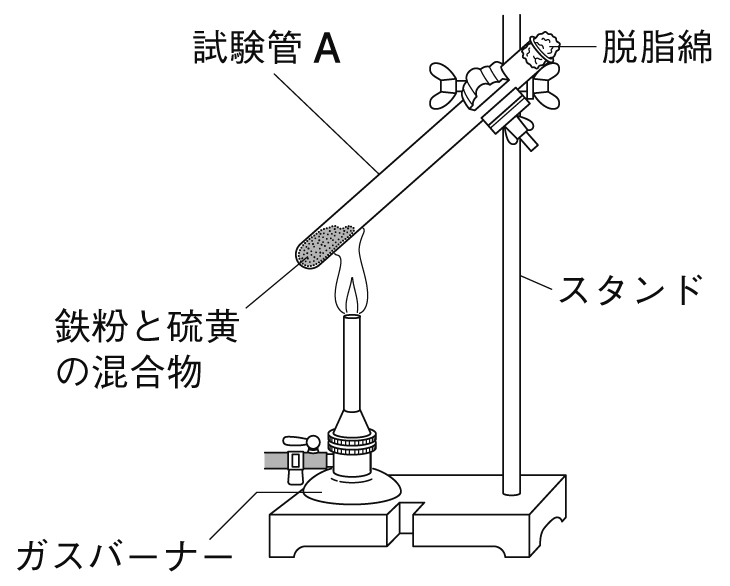
この実験で加熱する際は、鉄と硫黄の混合物の上部を加熱する。
反応が始まったら、火を消してよい。
その理由は、化学変化で発生した熱により、加熱をやめても反応が進むためである。
硫化鉄の化学式はFeS
加熱前の物質(鉄と硫黄の混合物)は灰色+黄色。
加熱後の物質(硫化鉄)は黒色。
加熱前の物質(鉄と硫黄の混合物)は磁石につく。
加熱後の物質(硫化鉄)は磁石につかない。
加熱前の物質(鉄と硫黄の混合物)にうすい塩酸を加えると、水素(においがない気体)が発生する。
加熱後の物質(硫化鉄)にうすい塩酸を加えると、硫化水素(特有の刺激臭・腐卵臭がある気体)が発生する。
鉄と硫化鉄は全く別の物質といえる。
この実験の化学反応式は Fe + S → FeS
② 銅と硫黄の化合
硫黄の蒸気の中に加熱した銅線を入れると、硫化銅ができる。
硫化銅の化学式はCuO
加熱前の物質(銅)は赤色で金属光沢がある。
加熱後の物質(硫化銅)は黒色である。
加熱前の物質(銅)はふれるとやわらかい。
加熱後の物質(硫化銅)はふれるともろい。
加熱前の物質(銅)は電気を通す。
加熱後の物質(硫化銅)は電気を通しにくい。
銅と硫化銅は全く別の物質といえる。
この実験の化学反応式は Cu + S → CuS
中学2年の化学実験まとめ(酸化)
物質が酸素と化合することを酸化という。
物質が熱や光を出しながら激しく酸化することを燃焼という。(燃えること)
① 鉄の燃焼
スチールウール(鉄のこと)を加熱すると燃焼がおこり、酸化鉄ができる。
加熱前の物質(鉄)は銀色で金属光沢がある。
加熱後の物質(酸化鉄)は黒色で、金属光沢が弱い。
加熱前の物質(鉄)は電気を通す。
加熱後の物質(酸化鉄)は電気を通しにくい。
加熱前の物質(鉄)は指でもんでもくずれない。
加熱後の物質(酸化鉄)はゆびでもむとぼろぼろになる。
加熱前の物質(鉄)はうすい塩酸に入れると水素が発生。
加熱後の物質(酸化鉄)はうすい塩酸に溶けにくい。
鉄を燃焼させ酸化鉄にすると、質量は増加する。
鉄と酸化鉄は全く別の物質といえる。
この実験の化学反応式は 鉄 + 酸素 → 酸化鉄
と覚えておけばよいです。
詳しい反応式は高校生以降で学習します。
② マグネシウムの燃焼
マグネシウムリボン(マグネシウムのこと)を加熱すると燃焼がおこり、酸化マグネシウムができる。
酸化マグネシウムの化学式はMgO
加熱前の物質(マグネシウム)は銀色で金属光沢がある。
加熱後の物質(酸化マグネシウム)は白色で、金属光沢が弱い。
マグネシウムを燃焼させ酸化マグネシウムにすると、質量は増加する。
マグネシウムと酸化マグネシウムは全く別の物質といえる。
この実験の化学反応式は 2Mg + O2 → 2MgO
③ 有機物の燃焼
燃焼して二酸化炭素を出す物質(炭素を含む物質)を有機物という。
燃焼しても二酸化炭素を出さない物質。または燃えない物質を無機物という。
この単元での有機物は、エタノール、ロウ、メタンなどがよく出題される。
ここで出題されるエタノール、ロウは炭素+水素と考えてよい。
有機物を燃焼すると、二酸化炭素と水が発生する。
有機物(炭素+水素) + 酸素 → 二酸化炭素 + 水
有機物を燃焼させたときに発生する気体を石灰水に加えると白くにごる。
メタンを燃焼させたときの化学反応式は CH4 + 2O2 → CO2 + 2H2O
④ 穏やかな酸化
光や熱を発生しない、穏やかな酸化を「さび」という。
金属がさびるのは、穏やかな酸化である。
中学2年の化学実験まとめ(還元)
物質から酸素がうばわれる化学変化を還元という。(酸化の逆)
① 酸化銅の還元
酸化銅に炭素(炭)を加えて加熱すると、酸化銅は銅になり、二酸化炭素が発生する。
酸化銅の化学式はCuO
この実験で発生した気体を石灰水に加えると、白くにごる。
加熱後の赤い物質をこすると、金属光沢を生じる。
この実験の化学反応式は 2CuO + C → 2Cu + CO2
物質から酸素がうばわれる化学変化を還元という。(酸化の逆)
① 酸化銅の還元
酸化銅に炭素(炭)を加えて加熱すると、酸化銅は銅になり、二酸化炭素が発生する。
酸化銅の化学式はCuO
この実験で発生した気体を石灰水に加えると、白くにごる。
加熱後の赤い物質をこすると、金属光沢を生じる。
この実験の化学反応式は 2CuO + C → 2Cu + CO2
 ねこ吉
ねこ吉またねー!
さわにいは、登録者8万人の教育YouTuberです。
中学の成績を上げたい人は、ぜひYouTubeも見てみてね!
また、2022年10月に学習参考書も出版しました。よろしくお願いします。
他のページも見たい人はトップページへどうぞ。


今なら相談無料です












コメント
コメント一覧 (12件)
こんにちは。
私は名古屋市で中学校教諭(理科担当)をしている者です。
さわにいさんのブログ、YouTubeを知り、生徒にも共有したいと思うようになりました。
そこでご相談なのですが、さわにいさんのブログ記事やYouTube動画のリンク(QRコード)を授業プリントに掲載させていただいてもよろしいでしょうか?
今の中学生はほとんどの子がスマホを持っており、家庭学習でもスマホやタブレットを使っての取り組みが増えてくると思います。
ご賛同いただけると幸いです。
ご検討よろしくお願い致します。
ウエシマ様初めまして。
まずもって、返信が大変遅れたことお詫びいたします。
ブログ記事やyoutubeなど、いつでも紹介くださいませ。
私ももと公立中学理科教員でした。
現場の先生方のことは今でも尊敬してやみません。
応援しております!
金属光沢の五行目水素が抜けてます!
ありがとうございます!
修正させていただきました!
陽極から酸素で陰極から水素ではないんですか?火を近づけたときの反応も逆な気がします!
ありがとうございます。修正いたしました。
今後ともご指導よろしくお願いいたします。
質問失礼します。2年理科科学をまとめたいのですが、これだけで全部ですか?
ほとんどまとめてあります!
教科書によっても違いますので、抜けがあったら申し訳ございません。
とても勉強になります!もうすぐ期末テストなので頑張ります!
テスト大変ですね!応援しています!
突然ですみません。中学二年生男子です。
酸化銅の酸化還元の化学反応式の 2CuO + C = 2Cu + CO2 が二つあると思いますが、
上の方の化学反応式が2CuO + C = 2Cu + CO になっており、
二酸化炭素が一酸化炭素になっていますよ。
修正しました。ありがとうございます!