化学反応式の書き方を1から学びたい人は、ここから勉強を始めてね!
中2で必要な「原子を表す記号(元素記号)」まとめ(一覧)
| 水素 | 酸素 | 炭素 |
| H | O | C |
| 窒素 | 塩素 | 硫黄 |
| N | Cl | S |
| ナトリウム | マグネシウム | 鉄 |
| Na | Mg | Fe |
| 銅 | 銀 | 亜鉛 |
| Cu | Ag | Zn |
| ヘリウム | アルゴン | カリウム |
| He | Ar | K |
| カルシウム | アルミニウム | 金 |
| Ca | Al | Au |
中2で必要な「化学式」まとめ(一覧)
重要 確認事項はここから
化学式の練習問題の前に、少しだけ確認しておこう。
確認① 原子の順番を入れ替えない。
水分子の化学式は「H2O」
だけど、これを「OH2」としてはいけないよ、
順番もしっかりとおぼえようね。
確認② 小さい数字は、前の原子の個数。
H2Oの「2」などの小さい数字は、「数字の前の原子の数」だよ。

つまり、H2Oの場合は、「H(水素原子)」が2個なんだね。
「H2O (水分子)」のモデル→ ![]()
CO2だったら、「2」の前にある「O(酸素原子)」が2個だね。
「CO2 (二酸化炭素分子)」のモデル→ ![]()
原子の後の数字まで、しっかりおぼえないといけないよ!
確認③ 化学式はアルファベットの大文字の前が原子の切れ目
化学式はアルファベットの大文字の前が原子の切れ目だよ。
NaCl → Na|Cl → ![]()
MgO → Mg|O → ![]()
CuO → Cu|O → ![]()
NaOH → Na|O|H → ![]()
FeS → Fe|S → ![]()
CuS → Cu|S → ![]()
NaHCO3 → Na|H|C|O3 → ![]()
Na2CO3 → Na2|C|O3 → ![]()
という感じだね。
| 水素 | 酸素 | 水 |
| H2 | O2 | H2O |
| 二酸化炭素 | 窒素 | アンモニア |
| CO2 | N2 | NH3 |
| 鉄 | 銅 | 銀 |
| Fe | Cu | Ag |
| 金 | アルミニウム | 炭素 |
| Au | Al | C |
| 硫黄 | 酸化銀 | 酸化銅 |
| S | Ag2O | CuO |
| 酸化マグネシウム | 塩化ナトリウム | 硫化鉄 |
| MgO | NaCl | FeS |
| 硫化銅 | 水酸化ナトリウム | 炭酸水素ナトリウム |
| CuS | NaOH | NaHCO3 |
| 炭酸ナトリウム | ||
| Na2CO3 |
中2で必要な「化学反応式」まとめ(一覧)
| 水素と酸素が化合し、水ができる。 |
| 2H2 + O2 → 2H2O |
| 水を分解し、水素と酸素ができる。 |
| 2H2O → 2H2 + O2 |
| 炭素が燃焼し、二酸化炭素ができる。 |
| C + O2 → CO2 |
| 酸化銀を分解し、銀と酸素ができる。 |
| 2Ag2O → 4Ag + O2 |
| 銅が酸化し、酸化銅ができる。 |
| 2Cu + O2 → 2CuO |
| マグネシウムが燃焼し、酸化マグネシウムができる。 |
| 2Mg + O2 → 2MgO |
| 炭酸水素ナトリウムを分解し、炭酸ナトリウム、水、二酸化炭素ができる。 |
| 2NaHCO3 → Na2CO3 + H2O + CO2 |
| 鉄と硫黄が化合する |
| Fe + S → FeS |
| 鉄と硫黄が化合する |
| Fe + S → FeS |
中2で必要な「化学反応式」作り方まとめ
まとめを読んでわからないことがあれば、下のボタンから練習してこよう!
水素と酸素が化合し、水ができる
書き方① 反応式を日本語で書く
水素 + 酸素 → 水
書き方② 日本語の部分を「化学式」に変える
H2+ O2→ H2O
書き方③ モデルを書いて原子の個数をそろえる
書き方②で書いた式の下にモデルを書くと、
H2 + O2 → H2O
![]() +
+ ![]() →
→ ![]()
矢印の左側と右側で、原子の粒の数が同じかを確かめる。
矢印の左側 … 水素原子(![]() )が 2つ。酸素原子(
)が 2つ。酸素原子(![]() )が2つ
)が2つ
矢印の右側 … 水素原子(![]() )が 2つ。酸素原子(
)が 2つ。酸素原子(![]() )が1つ
)が1つ
矢印の左と右で原子(酸素原子)の個数があっていない。
右側の酸素原子を増やすと。
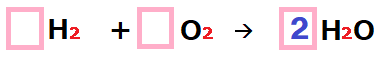
![]() +
+ ![]() →
→ ![]()
![]()
矢印の左側 … 水素原子(![]() )が 2つ。酸素原子(
)が 2つ。酸素原子(![]() )が2つ
)が2つ
矢印の右側 … 水素原子(![]() )が 4つ。酸素原子(
)が 4つ。酸素原子(![]() )が2つ
)が2つ
となる。
今度は矢印の左と右で原子(水素原子)の個数があっていない。
左側の水素を増やすためにH2の前に係数をつけて…。
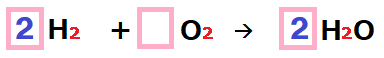
![]()
![]() +
+ ![]() →
→ ![]()
![]()
矢印の左側 … 水素原子(![]() )が 4つ。酸素原子(
)が 4つ。酸素原子(![]() )が2つ
)が2つ
矢印の右側 … 水素原子(![]() )が 4つ。酸素原子(
)が 4つ。酸素原子(![]() )が2つ
)が2つ
個数がそろったので、これで完成。
答え 2H2 + O2 → 2H2O
水を分解し、水素と酸素ができる
書き方① 反応式を日本語で書く
水 → 水素 + 酸素
書き方② 日本語の部分を「化学式」に変える
H2O → H2 + O2
書き方③ モデルを書いて原子の個数をそろえる
書き方②で書いた式の下にモデルを書くと、
H2O → H2 + O2
![]() →
→ ![]() +
+ ![]()
矢印の左側と右側で、原子の粒の数が同じかを確かめる。
矢印の左側 … 水素原子(![]() )が 2つ。酸素原子(
)が 2つ。酸素原子(![]() )が1つ
)が1つ
矢印の右側 … 水素原子(![]() )が 2つ。酸素原子(
)が 2つ。酸素原子(![]() )が2つ
)が2つ
矢印の左と右で原子(酸素原子)の個数があっていない。
左側の酸素原子を増やすと。

![]()
![]() →
→ ![]() +
+ ![]()
矢印の左側 … 水素原子(![]() )が 4つ。酸素原子(
)が 4つ。酸素原子(![]() )が2つ
)が2つ
矢印の右側 … 水素原子(![]() )が 2つ。酸素原子(
)が 2つ。酸素原子(![]() )が2つ
)が2つ
となる。
今度は矢印の左と右で原子(水素原子)の個数があっていない。
右側のH2の前に係数をつけて…。

![]()
![]() →
→ ![]()
![]() +
+ ![]()
矢印の左側 … 水素原子(![]() )が 4つ。酸素原子(
)が 4つ。酸素原子(![]() )が2つ
)が2つ
矢印の右側 … 水素原子(![]() )が 4つ。酸素原子(
)が 4つ。酸素原子(![]() )が2つ
)が2つ
個数がそろったので、これで完成。
答え 2H2O → 2H2 + O2
炭素が燃焼し、二酸化炭素ができる
書き方① 反応式を日本語で書く
炭素 + 酸素 → 二酸化炭素
書き方② 日本語の部分を「化学式」に変える
C + O2 → CO2
書き方③ モデルを書いて原子の個数をそろえる
書き方②で書いた式の下にモデルを書くと、
C + O2 → CO2
![]() +
+ ![]() →
→ ![]()
矢印の左側と右側で、原子の粒の数が同じかを確かめる。
矢印の左側 … 炭素原子(![]() )が1つ。酸素原子(
)が1つ。酸素原子(![]() )が2つ
)が2つ
矢印の右側 … 水素原子(![]() )が1つ。酸素原子(
)が1つ。酸素原子(![]() )が2つ
)が2つ
個数がそろっているので、これで完成。
答え C + O2 → CO2
酸化銀を分解し、銀と酸素ができる
書き方① 反応式を日本語で書く
酸化銀 → 銀 + 酸素
書き方② 日本語の部分を「化学式」に変える
Ag2O → Ag + O2
書き方③ モデルを書いて原子の個数をそろえる
書き方②で書いた式の下にモデルを書くと。
![]() →
→ ![]() +
+ ![]()
矢印の左側と右側で、原子の粒の数が同じかを確かめる。
矢印の左側 … 銀原子(![]() )が 2つ。 酸素原子(
)が 2つ。 酸素原子(![]() )が1つ
)が1つ
矢印の右側 … 銀原子(![]() )が 1つ。 酸素原子(
)が 1つ。 酸素原子(![]() )が2つ
)が2つ
矢印の左と右で原子(銀原子と酸素原子)の個数があっていない。
まずは左側の酸素原子を増やし数をそろえると、
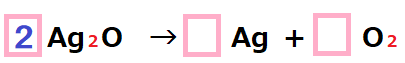
![]() →
→ ![]() +
+ ![]()
![]()
矢印の左側 … 銀原子(![]() )が 4つ。 酸素原子(
)が 4つ。 酸素原子(![]() )が2つ
)が2つ
矢印の右側 … 銀原子(![]() )が 1つ。 酸素原子(
)が 1つ。 酸素原子(![]() )が2つ
)が2つ
矢印の左と右で原子(銀原子)の個数がまだあっていない。
次に右側の銀原子を増やすと。

![]()
![]()
![]()
![]()
→ +![]()
![]()
![]()
![]()
矢印の左側 … 銀原子(![]() )が 4つ。 酸素原子(
)が 4つ。 酸素原子(![]() )が2つ
)が2つ
矢印の右側 … 銀原子(![]() )が 4つ。 酸素原子(
)が 4つ。 酸素原子(![]() )が2つ
)が2つ
個数がそろったので、これで完成。
答え 2Ag2O → 4Ag + O2
銅が酸化し、酸化銅ができる
書き方① 反応式を日本語で書く
銅 + 酸素 → 酸化銅
書き方② 日本語の部分を「化学式」に変える
Cu + O2 → CuO
書き方③ モデルを書いて原子の個数をそろえる
書き方②で書いた式の下にモデルを書くと、
Cu + O2 → CuO
![]() +
+ ![]() →
→ ![]()
矢印の左側と右側で、原子の粒の数が同じかを確かめる。
矢印の左側 … 銅原子(![]() )が 1つ。 酸素原子(
)が 1つ。 酸素原子(![]() )が2つ
)が2つ
矢印の右側 … 銅原子(![]() )が 1つ。 酸素原子(
)が 1つ。 酸素原子(![]() )が1つ
)が1つ
矢印の左と右で原子(酸素原子)の個数があっていない。
右側の酸素原子を増やすと。

![]() +
+ ![]() →
→ ![]()
![]()
矢印の左側 … 銅原子(![]() )が 1つ。 酸素原子(
)が 1つ。 酸素原子(![]() )が2つ
)が2つ
矢印の右側 … 銅原子(![]() )が 2つ。 酸素原子(
)が 2つ。 酸素原子(![]() )が2つ
)が2つ
今度は矢印の左と右で原子(銅原子)の個数があっていない。
左側のCuの前に係数をつけて…。
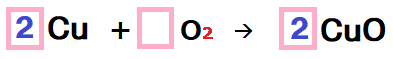
![]()
![]() +
+ ![]() →
→ ![]()
![]()
矢印の左側 … 銅原子(![]() )が 2つ。 酸素原子(
)が 2つ。 酸素原子(![]() )が2つ
)が2つ
矢印の右側 … 銅原子(![]() )が 2つ。 酸素原子(
)が 2つ。 酸素原子(![]() )が2つ
)が2つ
個数がそろったので、これで完成。
答え 2Cu → O2 + 2CuO
マグネシウムが酸化し、酸化マグネシウムができる
書き方① 反応式を日本語で書く
マグネシウム + 酸素 → 酸化マグネシウム
書き方② 日本語の部分を「化学式」に変える
Mg + O2 → MgO
書き方③ モデルを書いて原子の個数をそろえる
書き方②で書いた式の下にモデルを書くと、
Mg + O2 → MgO
![]() +
+ ![]() →
→ ![]()
矢印の左側と右側で、原子の粒の数が同じかを確かめる。
矢印の左側…マグネシウム原子(![]() )が1つ。酸素原子(
)が1つ。酸素原子(![]() )が2つ
)が2つ
矢印の右側…マグネシウム原子(![]() )が1つ。酸素原子(
)が1つ。酸素原子(![]() )が1つ
)が1つ
矢印の左と右で原子(酸素原子)の個数があっていない。
右側の酸素原子を増やして数をそろえると、

![]() +
+ ![]() →
→ ![]()
![]()
矢印の左側…マグネシウム原子(![]() )が1つ。酸素原子(
)が1つ。酸素原子(![]() )が2つ
)が2つ
矢印の右側…マグネシウム原子(![]() )が2つ。酸素原子(
)が2つ。酸素原子(![]() )が2つ
)が2つ
こんどは矢印の左と右で原子(マグネシウム原子)の個数があっていない。
左側のMgの前に係数をつけて…。
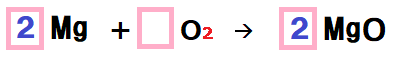
![]()
![]() +
+ ![]() →
→ ![]()
![]()
矢印の左側…マグネシウム原子(![]() )が2つ。酸素原子(
)が2つ。酸素原子(![]() )が2つ
)が2つ
矢印の右側…マグネシウム原子(![]() )が2つ。酸素原子(
)が2つ。酸素原子(![]() )が2つ
)が2つ
個数がそろったので、これで完成。
答え 2Mg → O2 + 2MgO
炭酸水素ナトリウムを分解し、炭酸ナトリウム、水、二酸化炭素ができる
書き方① 反応式を日本語で書く
炭酸水素ナトリウム → 炭酸ナトリウム + 水 + 二酸化炭素
書き方② 日本語の部分を「化学式」に変える
NaHCO3 → Na2CO3 + H2O + CO2
書き方③ モデルを書いて原子の個数をそろえる
書き方②で書いた式の下にモデルを書くと、
NaHCO3 → Na2CO3 + H2O + CO2
![]() +
+ ![]() +
+ ![]() +
+ ![]()
矢印の左側と右側で、原子の粒の数が同じかを確かめる。
矢印の左側…ナトリウム原子(![]() )が1つ。水素原子(
)が1つ。水素原子(![]() )が1つ。炭素原子(
)が1つ。炭素原子(![]() )が1つ。酸素原子(
)が1つ。酸素原子(![]() )が3つ。
)が3つ。
矢印の右側…ナトリウム原子(![]() )が2つ。水素原子(
)が2つ。水素原子(![]() )が2つ。炭素原子(
)が2つ。炭素原子(![]() )が2つ。酸素原子(
)が2つ。酸素原子(![]() )が6つ。
)が6つ。
矢印の左と右で原子の個数があっていない。
左側の炭酸水素ナトリウムの前に係数2をつけると。

![]() →
→ ![]() +
+ ![]() +
+ ![]()
![]()
矢印の左側…ナトリウム原子(![]() )が2つ。水素原子(
)が2つ。水素原子(![]() )が2つ。炭素原子(
)が2つ。炭素原子(![]() )が2つ。酸素原子(
)が2つ。酸素原子(![]() )が6つ。
)が6つ。
矢印の右側…ナトリウム原子(![]() )が2つ。水素原子(
)が2つ。水素原子(![]() )が2つ。炭素原子(
)が2つ。炭素原子(![]() )が2つ。酸素原子(
)が2つ。酸素原子(![]() )が6つ。
)が6つ。
答え 2NaHCO3 → Na2CO3 + H2O + CO2
NaHCO3 は「ナホコサン」Na2CO3は「ナツコサン」と覚えるといいよ☆
鉄と硫黄が化合する
書き方① 反応式を日本語で書く
鉄 + 硫黄 → 硫化鉄
書き方② 日本語の部分を「化学式」に変える
Fe + S → FeS
書き方③ モデルを書いて原子の個数をそろえる
書き方②で書いた式の下にモデルを書くと、
Fe + S → FeS
![]() +
+ ![]() →
→ ![]()
矢印の左側と右側で、原子の粒の数が同じかを確かめる。
矢印の左側 … 鉄原子(![]() )が1つ。硫黄原子(
)が1つ。硫黄原子(![]() )が1つ
)が1つ
矢印の右側 … 鉄原子(![]() )が1つ。硫黄原子(
)が1つ。硫黄原子(![]() )が1つ
)が1つ
個数がそろっているので、これで完成。
答え Fe + S → FeS
銅と硫黄が化合する
書き方① 反応式を日本語で書く
銅 + 硫黄 → 硫化銅
書き方② 日本語の部分を「化学式」に変える
Cu + S → CuS
書き方③ モデルを書いて原子の個数をそろえる
書き方②で書いた式の下にモデルを書くと、
Cu + S → CuS
![]() +
+ ![]() →
→ ![]()
矢印の左側と右側で、原子の粒の数が同じかを確かめる。
矢印の左側 … 銅原子(![]() )が1つ。硫黄原子(
)が1つ。硫黄原子(![]() )が1つ
)が1つ
矢印の右側 … 銅原子(![]() )が1つ。硫黄原子(
)が1つ。硫黄原子(![]() )が1つ
)が1つ
個数がそろっているので、これで完成。
答え Cu + S → CuS
 ねこ吉
ねこ吉またねー!
さわにいは、登録者8万人の教育YouTuberです。
中学の成績を上げたい人は、ぜひYouTubeも見てみてね!
また、2022年10月に学習参考書も出版しました。よろしくお願いします。
他のページも見たい人はトップページへどうぞ。


今なら相談無料です












コメント
コメント一覧 (13件)
鉄と銅が化合する
Cu + S → CuS
正しくは銅と硫黄だと思われます。
ご指摘の通り問題に誤りがありました。
修正を行いました。
本当にありがとうございました。
炭酸ナトリウムの化学式
Na₂Co₃です
修正いたしました。
申し訳ございません。
ご指摘いただきありがとうございました。
鉄と硫黄の化合
Cu + S → CuS
鉄ではなく、銅だと思います
ありがとうございます。
修正をさせていただきました。
申し訳ございませんでした。
色々間違えててとても草
間違いがありましたようで申し訳ございません。
どの点に誤りがございましたでしょうか?
モデルで描くの分かりやすすぎる……H₂Oが化学反応式で2H₂Oに変化する理由今までずっと謎だったけどこれで謎が解けました!
お役に立ててよかったです!
わかりやすっ。神か。
とても分かりやすいでした。
お役に立てて良かったです!